Mudança da Anvisa deve facilitar chegada da Sputnik V ao Brasil
Modificação de requisitos para pedidos de uso emergencial de imunizantes contra a covid-19 favorece a chegada de novas vacinas ao Brasil
Publicado 03/02/2021 - 13h39
São Paulo – A Agência Nacional de Vigilância Sanitária (Anvisa) vai modificar os requisitos para pedidos de uso emergencial de vacinas contra a covid-19 nesta quarta-feira (3), deixando de exigir que o imunizante esteja com a fase 3 de testes em andamento no Brasil. As informações são da CNN Brasil.
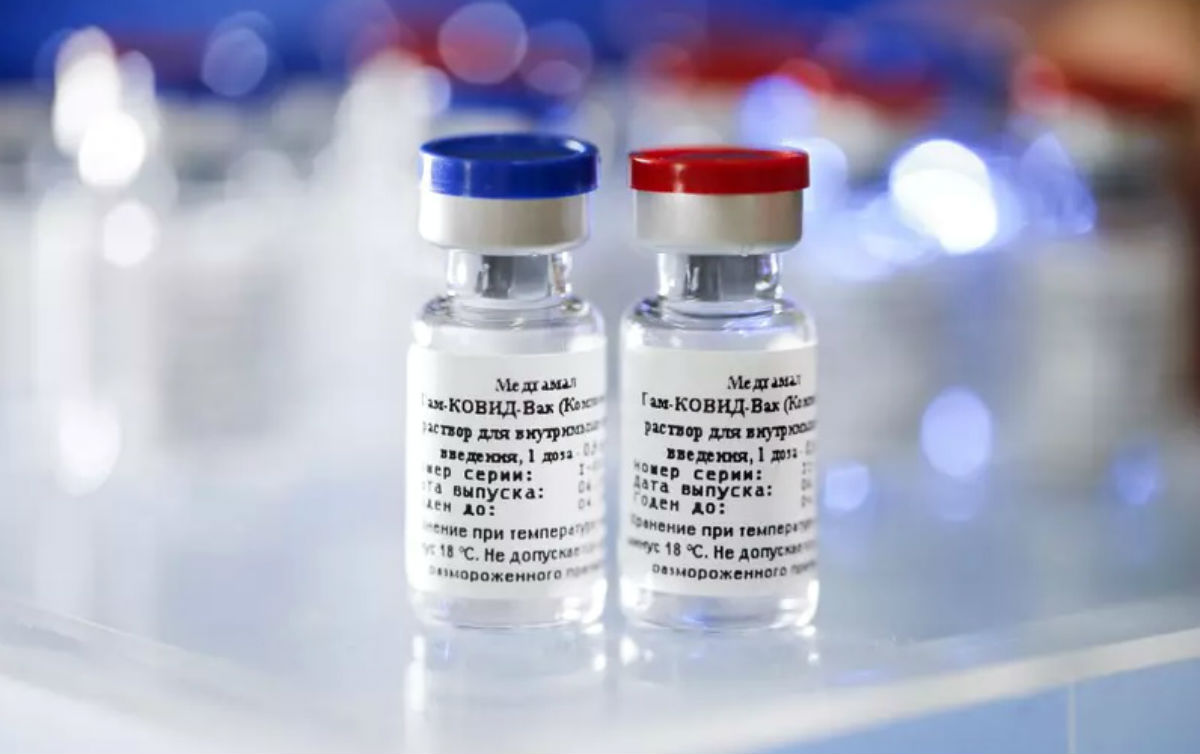
A mudança deve facilitar a liberação provisória para uso da vacina russa Sputnik V, que tem eficácia de 91,6% contra a doença, segundo os resultados preliminares publicados nesta terça-feira (2) na revista científica The Lancet. O estudo publicado também demonstrou que o imunizante tem eficácia de 100% contra casos moderados e graves da doença.
“Lembrando que os dados da fase 3 são obrigatórios para a análise de uso emergencial! O que deixa de ser obrigatório é a condução da fase 3 envolvendo/no Brasil! Isso amplia nossas possibilidades de aquisição de novas vacinas como a Novavax, Sputnik V por exemplo” explica, em seu perfil no Twitter, a biomédica e pós-doutoranda em Bioquímica na Universidade Federal do Rio Grande do Sul (UFRGS) Mellanie Fontes-Dutra, sobre a decisão da Anvisa.
“Todo o rigor da análise é mantido, e tendo dados de diferentes países, diferentes faixas etárias, etnias, de populações com diferentes fundos genéricos, podemos estar diante da aprovação de imunizantes com uma excelente capacidade de proteger a nossa população”, explica. “Vacinas como a Sputnik-V, Novavax podem, agora, ser uma possibilidade real pra nós. Vejo com bastante otimismo essa estratégia da Anvisa e espero que, em breve, possamos estar vendo mais imunizantes solicitando aprovação de uso emergencial aqui no BR – precisamos.”
Poucas horas após a publicação do The Lancet sobre a eficácia da Sputnik V, o governo do México autorizou o uso emergencial do imunizante produzido pelo instituto russo Gamaleya. O anúncio oficial foi feito pelo subsecretário de Saúde, Hugo López e o país deve receber nos próximos dias o primeiro lote com 400 mil doses.